PET/fMRI对异常脑活动的精准定位:研究进展与展望
发布时间:2018-01-05 浏览次数:0
摘要
许多脑疾病无明显病灶,其病因可能是源于脑活动或脑区连通性的异常。目前常用的脑成像诊断技术很难对其异常脑活动进行精准定位。新近发展起来的PET/MR一体同步显像技术或能弥补此缺陷。该设备已经用于临床诊断,但主要还是利用了PET功能影像与MRI结构影像的结合,远远没有发挥其"功能-功能"结合的诸多优势。目前,国际上PET/fMRI的研究尚处于起步阶段。初步研究表明,PET与fMRI常用功能指标之间的相关性并不高,提示2种功能指标可能揭示了不同的生理、病理机制。目前,我国大型研究型医院已经安装了至少5台一体化PET/MR设备。相对来说,我国的优势在于病源充足,PET影像发展迅速,且在fMRI的计算方法学方面有较高的国际地位。PET/fMRI的研究通常需要多学科的合作,包括核医学、放射学、化学、医用物理学、影像计算方法学、认知神经科学等等,我国医院的科研管理体制还需要改进,以满足这种多学科高度交叉合作的需求。利用自身优势,改进自身科研管理体制,再加上多中心合作,相信我国在PET/fMRI的研究方面能够很快达到国际一流水平,并取得既有科学价值、又有临床价值的科研成果。
一、异常脑功能的定位诊断与定位脑刺激治疗
许多脑疾病无明显的结构异常、而以脑功能障碍为主要表现,如PD、AD、抑郁症等。脑功能异常疾病的诊断缺乏客观指标,治疗以药物为主。目前,靶向定位脑刺激技术在脑疾病的功能调控及治疗方面显示出了巨大的前景。这些技术中,有些已广泛用于临床,如深部脑刺激(deep brain stimulation, DBS)和经颅磁刺激(transcranial magnetic stimulation, TMS),有些还处于研究阶段,如低频聚焦超声刺激(focused ultrasound stimulation,FUS)。DBS、TMS、FUS的共同优势在于其刺激靶点比较精确,其共同特点是需要对刺激靶点进行精准定位。虽然在导航的引导下,对指定位置进行准确刺激并不困难,但刺激靶点确定是一项非常具有挑战性的工作。目前只有极少数脑疾病的特定症状有比较明确的靶点,如丘脑底核或内侧苍白球的DBS对PD的肢体症状有明确的疗效,背外侧前额叶是TMS治疗抑郁症的有效刺激靶点。在绝大多数情况下,刺激靶点并不明确。无创脑功能成像技术,特别是一体化PET/MRI设备的问世,有望解决这一问题。
二、PET与MRI的功能成像特点与数据分析方法
1.PET。PET既属于功能影像学,也属于分子影像学。采用的放射性核素(如11C、13N、15O、18F)本身就是体内各种物质的基本元素,带有这些核素的示踪剂的特异性比较高。目前临床广泛使用的是18F-FDG PET,可反映体内细胞葡萄糖的代谢。与其他功能影像学技术相比较,PET的优势之一在于其可以特异性地标记并测定与神经递质代谢相关的物质或者与脑内某些功能蛋白有特异性结合的物质。
FDG PET的常用观察指标是SUV。该指标受许多因素影响,如注射时间、采集时间、血糖水平等。另一种方法在研究中应用比较多,即将每个体素的值除以全脑的平均值[1], 是相对于全脑总量的标准化方法,在静息态fMRI(resting-state fMRI, RS-fMRI)的研究中也经常采用。需要说明的是,这2个方法得到的结果有所不同,但没有对错之分。
2.fMRI。(1)定义。狭义的fMRI通常指的是血氧合水平依赖(blood oxygenation level dependent, BOLD)的fMRI技术。脱氧血红蛋白是一种顺磁性物质,BOLD-fMRI对于脱氧血红蛋白的变化比较敏感。动脉自旋标记(arterial spin labeling, ASL)MRI技术也是无创脑功能成像,也可以称为fMRI,该技术对脑血流(cerebral blood flow, CBF)的变化比较敏感。目前的新型扫描仪都配备BOLD和ASL这2种技术。其中,BOLD反映的指标是脱氧血红蛋白,其优点是时间分辨率比较高(约为0.1~2.0 s)、信噪比比较高,但缺点是无法定量;ASL反映的指标是血流,其优点是可进行定量分析,但缺点是时间分辨率比较低(约为4 s或者更长)、信噪比比较低。本文中,如果没有特别说明,fMRI默认为是指BOLD-fMRI。
(2)分类。可以根据扫描过程中的实验设计,将fMRI分为2大类,即任务fMRI和RS-fMRI,前者在扫描过程中需要受试者完成特定的任务,后者不需要完成特定的任务,自然休息即可。1995年Biswal等[2]发表了第1篇RS-fMRI方面的论文,但并未受到重视。而近年来,每年约有1 000篇相关的研究论文发表,这在很大程度上是由于RS-fMRI具有较大的临床应用价值。任务fMRI用于揭示特定任务状态下的脑活动,其作用是不可替代的,某些简单的任务设计已经被用于神经外科的术前功能定位,但由于任务设计千变万化,大范围临床应用比较困难。因此,本综述对于任务fMRI不作深入讨论。
(3)RS-fMRI数据分析方法简介。①功能整合与功能分离。fMRI的信号无法定量,只能分析其相对变化。RS-fMRI是一个四维数据,其分析方法大致可以分为2类,一类称为功能整合,另一类称为功能分离。功能整合RS-fMRI关注的是脑区与脑区之间的关系,也即网络或者功能连接,这种关系可以是无方向性的,也可以是有方向性的或者有因果关系的,后者又被称为效应连接。刻画功能连接或者脑网络的方法非常多,如基于种子感兴趣区的功能连接、独立成分分析、图论等,其中基于种子感兴趣区的功能连接方法最为简单、应用也最为广泛。功能整合分析方法的优点之一是可以更好地揭示脑的复杂性,但其缺点是不能刻画某个脑区本身的活动特点。以最简单的功能连接为例,A与B 2个脑区之间的功能连接异常,只能说明2个脑区之间的关系异常,无法说明A或者B本身是否异常。而功能分离的分析方法,并不关心脑区与脑区之间的关系,只关注局部的脑活动,这类方法也有许多,其中以低频振幅(amplitude of low frequency fluctuation, ALFF)[3]和局部一致性(regional homogeneity, ReHo)[4]应用较为广泛[5]。
ALFF反映的是每个体素本身的单个时间序列的信号波动幅度的大小,这与EEG研究中的"功率"或者"能量"等概念没有本质区别;从统计学上看,反映的都是某个频段的信号的离均差、标准差或者方差,都是一个相对值。例如,对1组临床诊断为内侧颞叶癫患者的研究[6]发现,在发作间期内侧颞叶的ALFF增高,并且在某种程度上与棘慢波的个数呈正相关。需要注意的是,ALFF这一术语中的"低频"一般指 <0.1 Hz的BOLD信号,当时采用"低频"这一概念,是因为有研究[2]认为RS-fMRI信号的"低频振荡"有生理意义。但随着扫描技术的进步,目前某些技术[如多带(multi-band)]的重复时间(time of repetition, TR)可以短至0.5 s以下,可分析的频段很宽,ALFF中的"低频"概念就不太合适了,如果不用"低频"而仅用"振幅"这一概念,则有更好的包容性。此外,ALFF与电生理信号波动的相关性还没有明确的基础研究报道,如果采用同步fMRI和局部场电位记录技术,探讨同一个部位的RS-fMRI的振幅与局部场电位的振幅的关系,将有助于理解RS-fMRI ALFF的电生理机制。
ReHo也是通过逐个体素(voxel-wise)分析的方式来分析局部活动特征的,但其反映的是相邻的多个体素(一般选择27个)之间的时间序列的同步性。有研究[7]发现,全面性强直-阵挛性癫发作的患者在发作间期,其丘脑内部的ReHo增高,提示丘脑内部活动的过度同步化可能是癫发作的机制之一。
②全脑逐个体素分析(whole-brain voxel-wise analysis, WBVWA)。首先需要说明的是,功能整合与功能分离是相对而言的。比如,尽管ReHo被归类为功能分离的方法,但也可以认为ReHo是一种局部的功能整合的方法。此外,方法学本身也有不同的分类方法。有些研究是在体素水平上进行分析,而有些是在脑区水平上进行分析;有些分析了全脑,而有些只针对某个网络。因此,有些方法属于WBVWA,常用的包括ALFF、ReHo以及图论中的中心度(degree centrality),这些方法在用于比较2组的差异时,不同研究之间的方法非常相似,便于将来的荟萃分析;但有些方法则不属于WBVWA,比如基于种子点的功能连接方法以及独立成分分析方法,在比较组间差异时,通常局限于在特定的脑网络内部进行比较,由于不同研究之间感兴趣的网络有所不同、定义网络的方法也会有所不同,故不太适合荟萃分析。图论是用来计算复杂网络的常用方法,在图论的众多指标中,中心度相对来说是最简单的指标,通常以WBVWA的方式计算某个体素与全脑所有体素的功能连接强度的总合,以反映该节点的重要性[8,9]。但图论中的多数方法,由于计算量非常大,通常是基于脑区水平、而不是逐个体素进行分析的。由于不同研究对于脑区的选取方法不同,且脑区相对比较大、定位不够精准,基于图论的荟萃分析也比较少。
(4)ASL-fMRI数据处理方法简介。ASL技术采用特殊的序列对动脉血中的水质子进行标记,被标记的动脉血液流入到组织,导致组织的磁敏感性发生变化,此时成像得到一幅标记图像(tag image或label image);之后再扫描一幅没有标记的对照图像(control image)。标记图像减去对照图像,即得到CBF加权的图像。ASL的扫描序列有多种,其时间分辨率从数秒到数分钟不等,有些三维ASL序列采用的是快速自旋回波,优点是图像变形很小,但基本上没有时间序列,只能得到一幅平均的CBF图像。而有些时间分辨率较高的ASL扫描序列,是基于平面回波成像的,虽然图像变形比较严重,但扫描速度较快,大约每4 s获得一幅CBF图像。这样,除了得到一段时间的平均CBF之外,也可以对时间序列的动态特征进行分析。借助一些计算模型,可以将CBF图像换算为单位时间流经单位体积脑组织的绝对血流量。CBF的时间序列图像,其分析方法与上述介绍的RS-fMRI的分析方法基本相同,也可以分为功能整合分析方法和功能分离分析方法。比如,有ASL研究[10]发现,默认网络的一段时间的平均CBF、CBF的ALFF、CBF的ReHo值,都显著高于全脑的平均值。平均CBF在脑内的分布模式与FDG PET的分布模式相似[1],而CBF的ALFF和ReHo的脑内分布模式与RS-fMRI的结果类似[3,4,10]。但由于ASL的信噪比比较低,其时间序列分析得到的结果的特异性和灵敏度都不如BOLD信号的时间序列分析结果。
(5)ASL与RS-fMRI的结合研究。目前的新型MR都配备ASL和BOLD这2种技术,许多研究以"准同步"的方式,相隔数分钟先后获取RS-fMRI和ASL。尽管fMRI与ASL-fMRI同属于血流动力学技术,但2种技术得到的结果不同,这主要是因为:(1)脑血流变化率与血氧变化率存在明显的不匹配现象,以手指运动为例,与静息状态相比较,脑血流的变化率约30%,而血氧的变化率通常只有约5%[11];(2)2种技术的信噪比等技术参数有明显不同;(3)虽然2种技术的数据某些分析方法相似(如功能连接分析),但有些分析方法却不同。
基础研究中将ASL与BOLD这2种技术结合进行网络分析的有很多,而临床研究则采用WBVWA方法的比较多。考虑到临床的实用性,这里仅介绍几例采用WBVWA方法的BOLD与ASL RS-fMRI相结合的研究。
例1是BOLD与ASL的相关性研究。Li等[12]发现,数分钟的平均CBF与BOLD的ALFF和ReHo在有些脑区表现为显著的正相关,但从该文章的图(图1)上看,这些相关的脑区显得有些分散,并且默认网络的脑区平均CBF与BOLD-ALFF或者BOLD-ReHo的相关性并不是非常强。
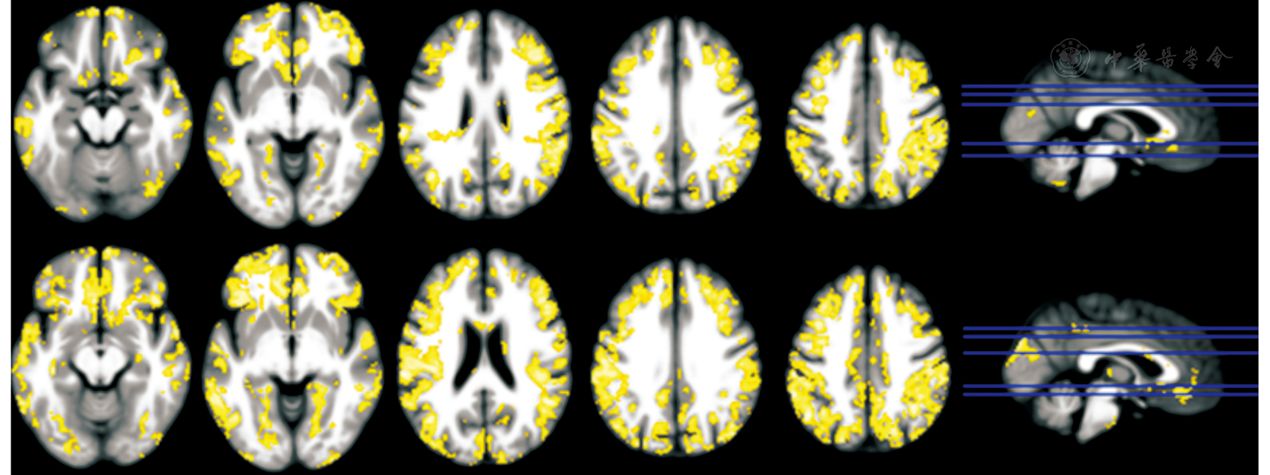
图1 动脉自旋标记(ASL)的一段时间的平均脑血流(CBF)与静息态fMRI(RS-fMRI)的局部一致性(ReHo;上图) 和低频振幅(ALFF;下图) 的相关性结果(P<0.005,未校正)。图引自参考文献[12]
在例2中,Zou等[13]采用BOLD和ASL 2种技术比较睁眼与闭眼状态之间的差异,该研究在美国和我国分别采集了数据,在美国采用的ASL可以进行时间序列分析,每4 s得到一幅CBF的图像,既分析了ASL平均CBF,又分析了CBF-ALFF。BOLD信号分析的指标是ALFF。所有的分析都是在单个体素水平进行的。该研究发现,在感觉运动区、听觉区以及枕外侧视觉区,闭眼状态下的BOLD-ALFF显著高于睁眼状态;听觉区的CBF-ALFF也是在闭眼状态高于睁眼状态,与BOLD-ALFF的差异区域重叠;但平均CBF结果与前二者完全没有重叠:在初级视觉区,睁眼状态下的平均CBF显著高于闭眼。也就是说,BOLD与ASL这2种不同的技术,如果采用相同的分析方法ALFF,发现结果有一定重叠;而同一种ASL技术采用不同的分析方法,得到的结果却截然不同,空间上没有重叠(图2)。
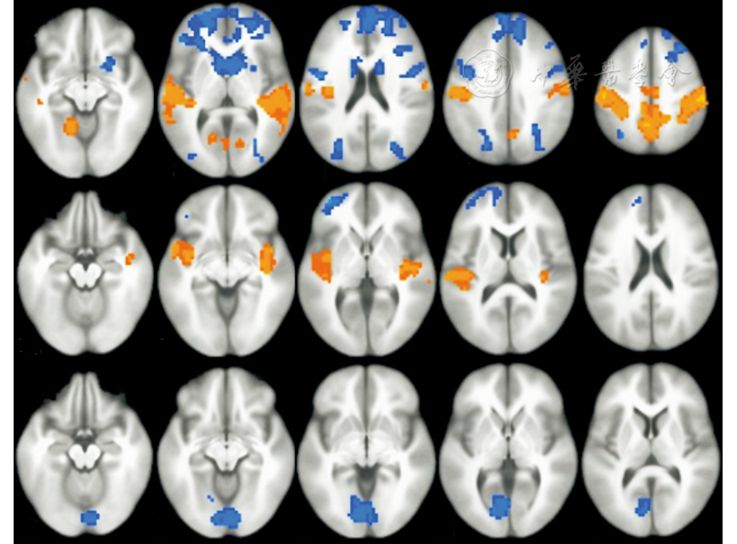
图2 闭眼状态与睁眼状态之间的差异。用静息态fMRI(RS-fMRI) 血氧合水平依赖(BOLD)-低频振幅(ALFF;上)和动脉自旋标记(ASL)CBF-ALFF(中)得到的差异图在听觉区附近有一定程度的重叠,均表现为闭眼状态的振幅高于睁眼状态;用ASL的一段时间的平均CBF(下)得到的差异主要位于初级视觉区,表现为闭眼状态低于睁眼状态,与BOLD-ALFF以及CBF-ALFF得到的差异完全没有重叠。图引自参考文献[13]
三、PET/fMRI相结合的研究
在下面讨论的PET/fMRI的结合研究,只限于对同一批被试既采集了PET数据、又采集了fMRI数据的研究,并且只讨论静息态的研究。有些PET与fMRI的结合研究可能未必是同步采集,但仍然在这里一并讨论。
1.PET/fMRI结合研究的成像技术。前面提到,fMRI包括BOLD和ASL 2种技术,由于BOLD-fMRI的应用更加普遍,PET/fMRI的结合研究中,也主要是PET与BOLD-fMRI的结合研究。
2.PET/fMRI结合研究的分析方法。(1)PET局部脑活动与fMRI的网络属性的相关性分析方法。BOLD-fMRI研究中常用的分析方法是功能整合,也即网络分析,而PET研究多数采用的是WBVWA的局部脑活动分析方法。PET/fMRI的结合研究中,有不少研究关注的是PET检测的局部脑活动(常用的指标是每个体素的测量值)与fMRI网络属性的关联性分析。由于网络属性非常复杂、采用的指标多种多样,结果也比较复杂。本文对此不作重点讨论。考虑到临床的实用性,后面仅介绍几例采用WBVWA方法的研究。对于RS-fMRI来说,WBVWA的指标主要包括ALFF、ReHo和中心度。
PET的局部指标与fMRI的局部指标的相关性分析,常用的至少有以下2种方式:①逐个被试的跨体素空间相关(spatial correlation across voxels, SCAV)。SCAV分析的是2张图的相似性。具体来说,先通过重复采样使PET的某个指标的图像与RS-fMRI的某个指标的图像的空间分辨率相同,然后将每个体素当作相关分析中的样本,每个图像构成一列数据,这样2列数据就可以进行相关分析。相关分析方法应用比较多的是Pearson线性相关分析。需要注意的几个问题是:这个"样本"非常大,通常有数万个体素,这样即使某个r值很小,其P值也会非常非常小,这样的"显著相关"就没什么太大价值;这种相关分析是在每个个体上进行分析的,在组水平时,有时采用平均的方法,也有将每个个体的r值转为z值之后做单样本t检验,推断组水平的显著性;严格来说,Pearson相关分析要求每个采样是独立的,而同一个人的脑中体素与体素之间显然不是互相独立的;Pearson相关分析要求样本呈正态分布,但脑内的数万个体素的值基本上不可能符合正态分布,其中一个重要的原因是体素之间不独立,另一个重要原因是不同组织(如白质与灰质)之间的值相差非常大。
这种空间相关用于分析2张图的模式是否相似,单纯从方法学本身看是没有什么问题的,即使不是同一个人的2张图像,仍然可以进行这种空间相关分析。比如,Buckner等[14]的一个类似的工作很受关注,他们先计算了127个健康人的RS-fMRI的中心度的平均图,然后计算了10例AD患者的PIB-PET显像的Aβ沉积的平均图。健康人RS-fMRI中心度在默认网络相关脑区的值很高,而AD患者Aβ沉积也主要表现在默认网络,他们将2张图进行跨体素的空间相关分析,发现其r值为0.68。也就是说,AD患者Aβ沉积的空间模式与健康人中心度的空间模式非常相似。但这种空间相关的方法,并不能判断某个部位的2个指标之间是否相关。如果在1篇文章内采用2种方法,既说明2张图的空间相似性,又说明2个指标在特定脑区的相似性,这才是更全面、更合理的分析。但遗憾的是,许多文章仅仅采用跨体素或者跨脑区的空间相关分析以证明2个测量指标的相关性,这有可能误导读者。
②逐个体素的跨被试相关(correlation across subjects, CAS)分析。这种CAS有时也称为被试间相关(between-subject correlation),实际上就是普通意义上的线性相关分析。比如有30位被试者,每位被试者既接受PET扫描也接受RS-fMRI扫描,通过重复采样使得2种模态的图像空间分辨率相同,然后逐个体素进行Pearson相关分析,判断每个体素中这2个指标的相关性,其样本量是30,而前面SCAV的样本是体素的数目,通常为数万。这种CAS分析符合Pearson相关分析的基本要求,比如样本之间互相独立(即人与人之间是独立的)、正态分布(PET或者RS-fMRI的标准化之后的指标是连续变量,一般可以假定符合正态分布)。
3.PET/fMRI结合研究举例。例1来自美国国立卫生研究院的1项研究[15]。该研究纳入8名健康被试和9例内侧颞叶癫患者,PET扫描包括FDG PET和GABA受体PET,RS-fMRI指标包括ALFF、ReHo和全脑连接(global connectivity)。此处的全脑连接是将全脑平均时间序列与全脑的每一个体素的时间序列进行相关分析得到的。PET与RS-fMRI是分别扫描的。对于2种模态的相关分析,作者既做了SCAV分析,也做了CAS分析,并且相关分析在健康对照组和患者组分别进行。SCAV分析结果显示,RS-fMRI的全脑连接这个指标与PET的2个指标(葡萄糖代谢与GABA受体浓度)的空间相关的r值分别为0.050到0.102, ALFF和ReHo与PET的2个指标的空间相关的r值分别为0.152到0.274,而PET的2个指标之间的空间相关的r值分别为0.760和0.784,也就是说,葡萄糖代谢与GABA受体浓度这2张图的空间模式非常相似。由于样本量较小(分别为8例和9例),CAS分析在PET指标与RS-fMRI指标之间未发现显著相关的脑区,而PET的2个指标之间,在某些脑区表现出显著的相关性,包括前扣带回、前岛叶等部位。从这个例子可以看出,SCAV分析发现葡萄糖代谢与GABA受体浓度2个PET图像的空间模式很相似;进一步的CAS分析结果提示,只有在少数脑区2个指标显著相关。
例2是来自意大利的1项研究[16],该研究纳入了19名被试,进行同步PET/fMRI扫描。PET的指标是葡萄糖代谢,RS-fMRI指标包括ReHo、fALFF和中心度。与例1相同,该研究既进行了葡萄糖代谢与RS-fMRI的3个指标的SCAV分析,也进行了CAS分析,并将相关分析限定在灰质之内。研究发现,在灰质概率大于0.3的情况下,葡萄糖代谢与RS-fMRI的ReHo、中心度、fALFF的空间相关系数平均值(共19名被试的r值进行平均)分别为0.53、0.50和0.56。而CAS分析结果发现,葡萄糖代谢与RS-fMRI的3个指标只在少数零散的脑区存在显著相关(图3)。
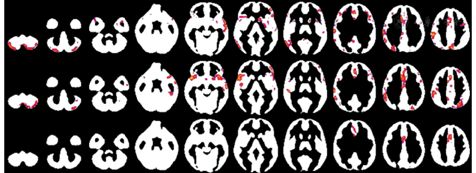
图3 FDG PET的葡萄糖代谢与静息态fMRI(RS-fMRI)3个指标的逐个体素跨被试相关。上:PET与局部一致性(ReHo);中:PET与功能低频振幅(fALFF);下:PET与中心度。葡萄糖代谢与RS-fMRI的3个指标仅在少数脑区存在显著相关。图引自参考文献[16]
例3是来自加拿大的1项研究[17],该研究纳入了27名健康青年人和35名健康老年人,分别进行FDG PET和RS-fMRI(非同步扫描),后者的分析指标包括ALFF、ReHo和中心度。但中心度并不是在体素水平上分析的,因此本文暂不讨论其中心度的内容。作者从3个角度比较了葡萄糖代谢与RS-fMRI指标关系:(1)青年组与老年组的两样本t检验研究发现,FDG PET所示差异脑区与RS-fMRI所示差异脑区既有重叠,又有不同,也就是说,PET与RS-fMRI 2种技术有互补性;(2)SCAV分析示葡萄糖代谢的空间模式与ReHo的非常相似,而与ALFF的相似程度比较低;(3)CAS分析示葡萄糖代谢与ALFF几乎没有在任何脑区呈现显著的相关,但与ReHo在许多脑区存在显著的相关,这种相关在老年组更显著(图4)[17]。老年组的相关性略强可能有以下2方面的原因:一是该研究中老年组的被试明显多于青年组,在同样的阈值下,样本量较大的一组其阳性结果更多;另外可能是因为老年组的年龄跨度比较大、被试间的变异也比较大,从而导致相关性更强。该文章将CAS分析结果图当作辅助材料呈现,并未放在正文中。该文章实际上强调的是空间相关的结果,文题"ReHo空间模式可以预测葡萄糖代谢"强调的也是FDG PET与RS-fMRI ReHo空间模式的相似性。这样的表述,可能会误导读者,使读者认为RS-fMRI的ReHo指标与FDG PET有很好的相关性,但实际上2个指标只在少数脑区上表现出有显著相关。
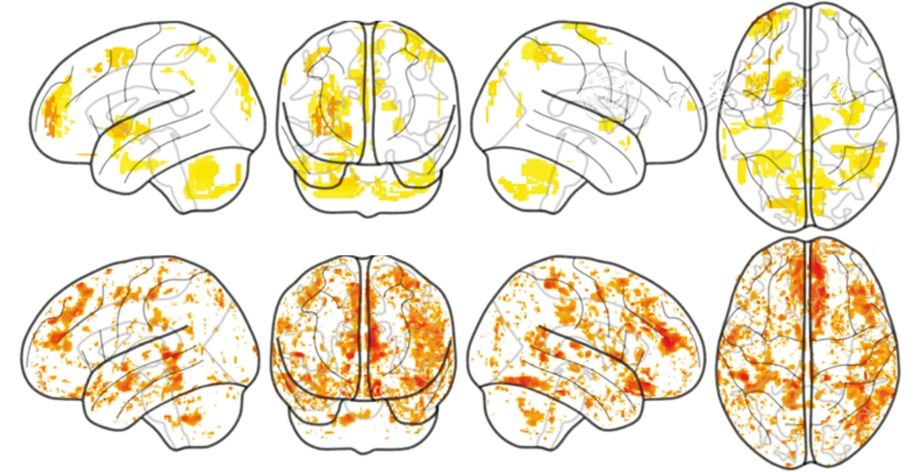
图4 FDG PET葡萄糖代谢与静息态fMRI(RS-fMRI)局部一致性(ReHo)的逐个体素的跨被试相关结果。在青年组(上),显著相关的脑区并不是很多,相关系数也不是很大;在老年组(下),显著相关的脑区更多一些,相关系数更大一些。图引自参考文献[17]
总而言之,上面3个例子都表明,PET图像与RS-fMRI的不同指标的图像有一定相似性,但是从全脑CAS分析的角度来看,葡萄糖代谢指标与RS-fMRI的ReHo、ALFF、中心度3个指标的相关性并不是非常高。其中一个很大的原因可能在于FDG PET的指标一般都是某一时段的平均值,而RS-fMRI BOLD信号的平均值没什么意义,ALFF、ReHo以及中心度等指标反映的都是其动态变化过程的信息。暂且不说PET与RS-fMRI反映的物质不同,即使是同一种ASL技术的2个指标(平均CBF与CBF-ALFF),得到的睁眼与闭眼之间的差异图也明显不同,说明计算方法的不同对结果的影响也非常大。
PET指标与RS-fMRI的指标之间相关性低,说明这些指标可能有不同的生理或者病理意义,因而有很大的互补性;反之,如果高度相关,则说明2种技术可以相互替代。以内侧颞叶癫为例,PET研究[18]通常认为,在发作间期患者的内侧颞叶代谢减低,然而,至少有2项RS-fMRI研究[6,19]发现,患者的内侧颞叶ALFF增高;并且,Zhang等[6]对部分患者在扫描RS-fMRI时同步记录脑电图,发现在一定范围内,棘慢波的个数与ALFF的高低呈正相关。这种RS-fMRI ALFF的增高与PET葡萄糖代谢的减低,看似矛盾,但如果根据Zou等[13]的研究,或许可以解释这种看似矛盾的结果:海马硬化、神经元减少,可能导致一段时间内的平均血流量或葡萄糖代谢水平减低;但由于发作间期棘慢波的存在,导致BOLD信号的低频波动变大。如果采用PET/fMRI在同一批内侧颞叶癫患者发现这样看似矛盾的结果,或将更加深入揭示癫的病理生理机制,进而帮助精准定位癫灶。
4.PET/fMRI技术难点与瓶颈。尽管PET/fMRI显示了很好的前景,但有几个基本问题尚需注意:(1)fMRI图像变形导致的图像配准问题。PET-MRI是同时获取的,理论上不存在图像配准的问题。但由于BOLD-fMRI的图像受磁敏感的影响比较大,在气窦附近的脑组织容易发生变形,而PET图像不存在这个问题。因此,在这些部位,PET图像与BOLD-fMRI图像的配准非常困难。随着fMRI的扫描技术的改进,变形问题有一定改善,但远不够成熟。
(2)PET与fMRI的信号特点与生理机制。PET与fMRI的生理机制不同,分析方法也不同。二者无显著相关的影响因素比较复杂,2种技术也各有其局限性。以FDG PET为例,PET图像的信号反映了一段时间内葡萄糖代谢的平均值或者总合,尽管PET信号在理论上的时间分辨率可以很高(比如在后处理时按照每2 s/帧截取),但由于信噪比比较低,很难像BOLD-fMRI那样进行时间序列分析(如计算ALFF、ReHo以及功能连接等)。BOLD-fMRI的时间分辨率比较高,但其缺点是特异性较差,真正值得关注的脱氧血红蛋白,只占BOLD-fMRI信号的非常小的一部分。BOLD信号的平均值一般只在同一个扫描时间段内进行比较才有一定意义。而不同扫描时间段、不同脑区之间的BOLD信号强度不可以直接比较。如果PET数据可以进行时间序列分析、BOLD-fMRI可以定量分析,PET/fMRI的结合就会发挥更大的作用。
四、我国PET/fMRI多学科交叉研究展望
PET/fMRI将目前最高端的2种功能脑成像技术结合并进行同步记录,有望对异常脑活动进行精准定位,在此基础上,有可能为定位脑刺激治疗提供精准的刺激靶点。尽管PET与结构MRI的临床应用已经开展,但PET/fMRI的"功能-功能"结合研究,在国际上才刚刚开始。我国公立医院目前已经安装了至少5台PET/MR一体机,这些医院无疑都是国内顶级的医院,如果仅仅利用其"功能-结构"的结合为临床诊断服务,其作用将得不到充分发挥,导致宝贵科研资源的闲置。因此,开展PET/fMRI的结合研究才可以最大限度地发挥PET-MRI一体机在脑功能及脑病研究方面的优势。
PET/fMRI的研究,显然需要多学科交叉合作。PET属于核医学科,但PET的各种特异性示踪剂需要专门的化学研究团队去开发;MRI一般属于放射科,但fMRI的数据处理相对比较复杂,通常需要专门的计算方法学研究团队;而人脑功能成像经常涉及复杂的认知过程,即便是静息状态下的脑功能,也与认知任务的脑功能密切相关,这就需要认知神经科学研究人员的参与;MRI的技术发展非常快,这又需要MR物理学家的参与;研究的各种脑疾病,则涉及到相关的临床学科。由于我国医院的管理体制问题,医院的专职科研编制通常比较少,很难建立大型的、高水平的多学科交叉研究团队。因此,如果想充分发挥PET/fMRI的研究优势,还需要创新的管理体制。
PET/fMRI的研究费用相对比较高,同时考虑到单中心采样可能存在的局限和偏倚,多中心合作显得更加必要。多中心合作研究过程中,针对某几个疾病,可以尽量采用相同的试验设计和扫描参数。我国病源充足,目前PET影像发展迅速,fMRI功能影像的计算方法也比较成熟。结合这些优势,通过多中心合作的PET/fMRI研究,就不难取得具有世界领先水平、既有临床应用价值又有重要科学价值的成果。
参 考 文 献
[1] RaichleME, MacLeodAM, SnyderAZ, et al. A default mode of brain function[J]. Proc Natl Acad Sci U S A, 2001, 98(2): 676-682. DOI:10.1073/pnas.98.2.676.
[2] BiswalB, YetkinFZ, HaughtonVM, et al. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI[J]. Magn Reson Med, 1995, 34(4): 537-541. DOI:10.1002/mrm.1910340409.
[3] ZangYF, HeY, ZhuCZ, et al. Altered baseline brain activity in children with ADHD revealed by resting-state functional MRI[J]. Brain Dev, 2007, 29(2): 83-91. DOI:10.1016/j.braindev.2006.07.002.
[4] ZangY, JiangT, LuY, et al. Regional homogeneity approach to fMRI data analysis[J]. Neuroimage, 2004, 22(1): 394-400. DOI:10.1016/j.neuroimage.2003.12.030.
[5] Di MartinoA, FairDA, KellyC, et al. Unraveling the miswired connectome: a developmental perspective[J]. Neuron, 2014, 83(6): 1335-1353. DOI:10.1016/j.neuron.2014.08.050.
[6] ZhangZ, LuG, ZhongY, et al. fMRI study of mesial temporal lobe epilepsy using amplitude of low-frequency fluctuation analysis[J]. Hum Brain Mapp, 2010, 31(12): 1851-15861. DOI:10.1002/hbm.20982.
[7] ZhongY, LuG, ZhangZ, et al. Altered regional synchronization in epileptic patients with generalized tonic-clonic seizures[J]. Epilepsy Res, 2011, 97(1-2): 83-91. DOI:10.1016/j.eplepsyres.2011.07.007.
[8] LiangX, ZouQ, HeY, et al. Coupling of functional connectivity and regional cerebral blood flow reveals a physiological basis for network hubs of the human brain[J]. Proc Natl Acad Sci U S A, 2013, 110(5): 1929-1934. DOI:10.1073/pnas.1214900110.
[9] LiaoXH, XiaMR, XuT, et al. Functional brain hubs and their test-retest reliability: a multiband resting-state functional MRI study[J]. Neuroimage, 2013, 83: 969-982. DOI:10.1016/j.neuroimage.2013.07.058.
[10] ZouQ, WuCW, SteinEA, et al. Static and dynamic characteristics of cerebral blood flow during the resting state[J]. Neuroimage, 2009, 48(3): 515-524. DOI:10.1016/j.neuroimage.2009.07.006.
[11] FoxPT, RaichleME. Focal physiological uncoupling of cerebral blood flow and oxidative metabolism during somatosensory stimulation in human subjects[J]. Proc Natl Acad Sci U S A, 1986, 83(4): 1140-1144.
[12] LiZ, ZhuY, ChildressAR, et al. Relations between BOLD-fMRI-derived resting brain activity and cerebral blood flow[J]. PLoS One, 2012, 7(9): e44556. DOI:10.1371/journal.pone.0044556.
[13] ZouQ, YuanBK, GuH, et al. Detecting static and dynamic differences between eyes-closed and eyes-open resting states using ASL and BOLD-fMRI[J]. PLoS One, 2015, 10(3): e0121757. DOI:10.1371/journal.pone.0121757.
[14] BucknerRL, SepulcreJ, TalukdarT, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer′s disease[J]. J Neurosci, 2009, 29(6): 1860-1873. DOI:10.1523/JNEUROSCI.5062-08.2009.
[15] NugentAC, MartinezA, D′AlfonsoA, et al. The relationship between glucose metabolism, resting-state fMRI BOLD signal, and GABA-binding potential: a preliminary study in healthy subjects and those with temporal lobe epilepsy[J]. J Cereb Blood Flow Metab, 2015, 35(4): 583-591. DOI:10.1038/jcbfm.2014.228.
[16] AielloM, SalvatoreE, CachiaA, et al. Relationship between simultaneously acquired resting-state regional cerebral glucose metabolism and functional MRI: a PET/MR hybrid scanner study[J]. Neuroimage, 2015, 113: 111-121. DOI:10.1016/j.neuroimage.2015.03.017.
[17] BernierM, CroteauE, CastellanoCA, et al. Spatial distribution of resting-state BOLD regional homogeneity as a predictor of brain glucose uptake: a study in healthy aging[J]. Neuroimage, 2017, 150: 14-22. DOI:10.1016/j.neuroimage.2017.01.055.
[18] MalmgrenK, ThomM. Hippocampal sclerosis-origins and imaging[J]. Epilepsia, 2012, 53Suppl 4: 19-33. DOI:10.1111/j.1528-1167.2012.03610.x.
[19] JiGJ, ZhangZ, ZhangH, et al. Disrupted causal connectivity in mesial temporal lobe epilepsy[J]. PLoS One, 2013, 8(5): e63183. DOI:10.1371/journal.pone.0063183.

